保證藥品質(zhì)量安全,制藥及設(shè)備企業(yè)功不可沒
近期,多地藥品安全監(jiān)督局,都發(fā)布了藥企因銷售不合格藥品而被罰的通報。如湖北省藥品監(jiān)督管理局就在日前通報了有5家企業(yè),因銷售不合格藥品被行政處罰。具體來看,這5家藥企被處罰的原因分別是:檢驗項目【性狀】、【檢查】項下裝量差異不符合規(guī)定,檢驗項目【檢查】項下“土大黃苷”不符合規(guī)定。
除此之外,江西省樟樹藥品監(jiān)督管理局在昨日也公開了對江西某藥企經(jīng)營劣藥的行政處罰。公告顯示,該公司經(jīng)營的“小通草”不符合中國藥典規(guī)定,被處沒收違法所得5267.75元。
業(yè)內(nèi)認(rèn)為,從近期假劣藥品頻頻被罰來看,在新版藥品管理法之下,行業(yè)對藥品質(zhì)量安全監(jiān)管力度正不斷加嚴(yán),同時違法成本也有了進(jìn)一步提高。事實(shí)上,為了提高制藥質(zhì)量,除了新版藥品管理法外,我國已出臺了一系列有力措施。但是制藥質(zhì)量要想得到真正的提高,關(guān)鍵還在制藥企業(yè)和制藥設(shè)備企業(yè)。
縱使政策再多再有利,制藥企業(yè)研發(fā)進(jìn)度跟不上,制藥設(shè)備無法滿足制藥生產(chǎn)需求,那么一切還是無稽之談。對此,業(yè)內(nèi)認(rèn)為,制藥以及制藥設(shè)備企業(yè)需要不斷加大研發(fā)的投入,才能從源頭上解決藥品質(zhì)量問題。現(xiàn)階段,國內(nèi)制藥企業(yè)其實(shí)已經(jīng)普遍認(rèn)識到《藥品生產(chǎn)質(zhì)量管理規(guī)范》GMP管理的重要性,并已開始廣泛使用該管理模式。制藥企業(yè)實(shí)行GMP管理,正從人員、材料、設(shè)備、質(zhì)量把控等方面嚴(yán)格按照國家標(biāo)準(zhǔn)要求。
值得注意的是,制藥設(shè)備往往與藥品生產(chǎn)有著密切的關(guān)系,沒有好的制藥設(shè)備,企業(yè)自然無法生產(chǎn)出高質(zhì)量的產(chǎn)品。因此,制藥企業(yè)在加大研發(fā)投入,規(guī)范化生產(chǎn)的同時,也還要及時加強(qiáng)對設(shè)備的更新?lián)Q代。據(jù)了解,目前為了滿足制藥企業(yè)設(shè)備的升級,制藥設(shè)備企業(yè)同樣已經(jīng)開始加大研發(fā)投入,不斷進(jìn)行創(chuàng)新升級,來為藥品質(zhì)量安全提供更好的設(shè)備保障。
據(jù)了解,為了制藥設(shè)備能更好地滿足藥品生產(chǎn)的需要,眾多企業(yè)已經(jīng)開始積極參與到行業(yè)的產(chǎn)學(xué)研發(fā)中,在優(yōu)化制藥工藝道路上不斷加速探索,并將其技術(shù)理念轉(zhuǎn)化應(yīng)用到產(chǎn)品中。例如,某干燥設(shè)備企業(yè)就利用人工智能技術(shù),來提高中藥烘干效率和節(jié)能效果,以及產(chǎn)品烘干品質(zhì)。目前,該公司干燥設(shè)備除了在國內(nèi)備受青睞外,還已出口到印度、馬來西亞、德國、日本等國家。
另外,中藥產(chǎn)品一直是藥品質(zhì)量不合格的重災(zāi)區(qū),有企業(yè)為加快推動包括制藥智能化等中藥制造領(lǐng)域的現(xiàn)代化發(fā)展。就選擇了通過推進(jìn)包括中藥智能制造在內(nèi)的醫(yī)藥工業(yè)4.0、醫(yī)藥智能制造,并與高校院所展開校企合作,來更好的服務(wù)廣大中藥企業(yè)。
除了要不斷提高制藥設(shè)備的創(chuàng)新升級外,業(yè)內(nèi)認(rèn)為,制藥企業(yè)還需要提高微生物檢測的規(guī)范化,掌握標(biāo)準(zhǔn)菌種純度與特性確認(rèn)和控制菌的鑒定方法,熟悉微生物鑒定的程序。尤其在微生物檢測方面,應(yīng)提升微生物檢測技術(shù)能力,為藥品質(zhì)量再加一把“安全鎖”。
總的來說,國內(nèi)制藥設(shè)備市場上的設(shè)備種類繁多,規(guī)格齊全,基本已能夠滿足制藥企業(yè)尤其是中小型企業(yè)藥品生產(chǎn)需求。而且值得一提的是,近年來隨著現(xiàn)代制藥工程技術(shù)的應(yīng)用及新學(xué)科的發(fā)展,也在一定程度上進(jìn)一步提升了制藥裝備水平,能夠更好的滿足藥企高質(zhì)量生產(chǎn)需求。但要注意的是,我國不少制藥裝備在當(dāng)前與國外相比仍處于較低的水平,市場上還存



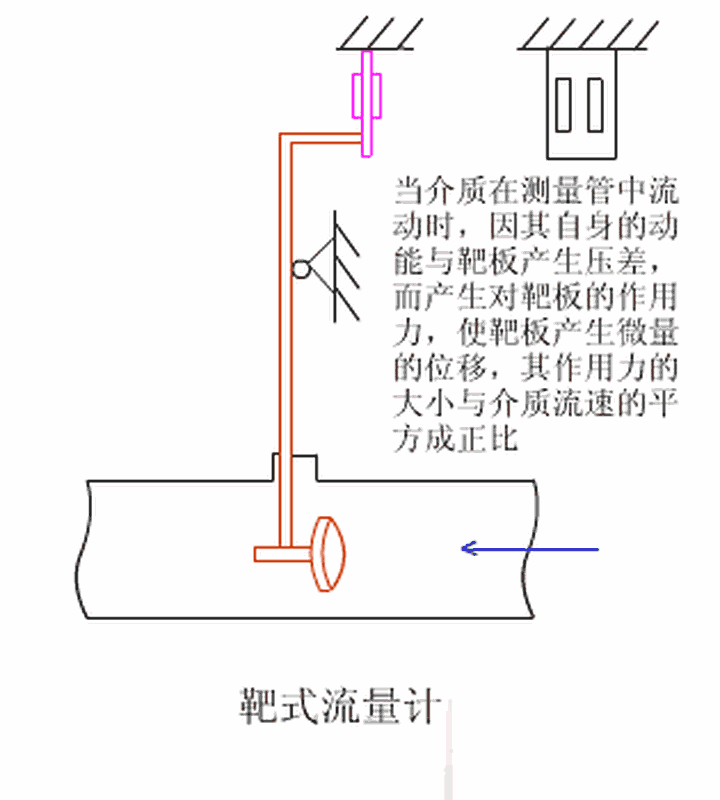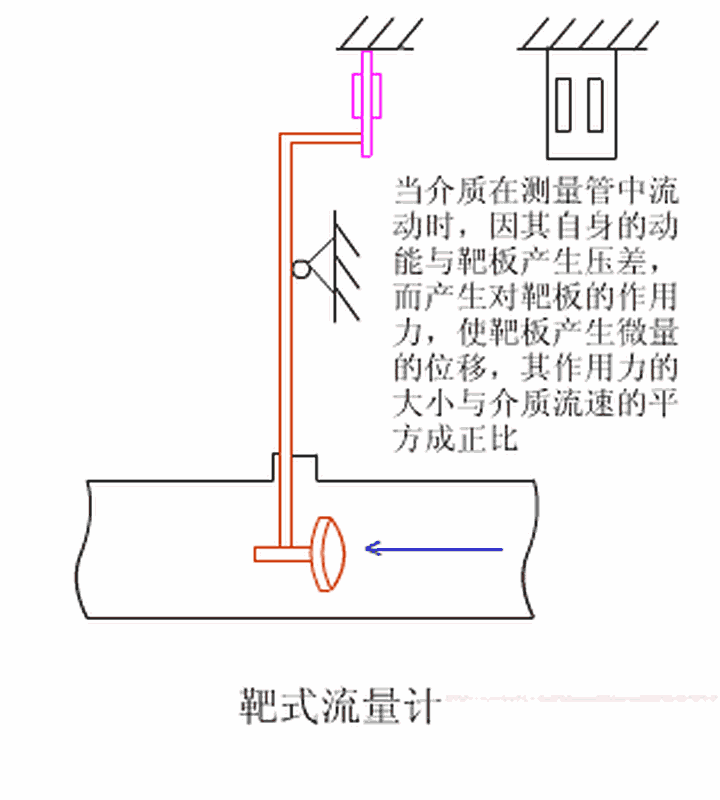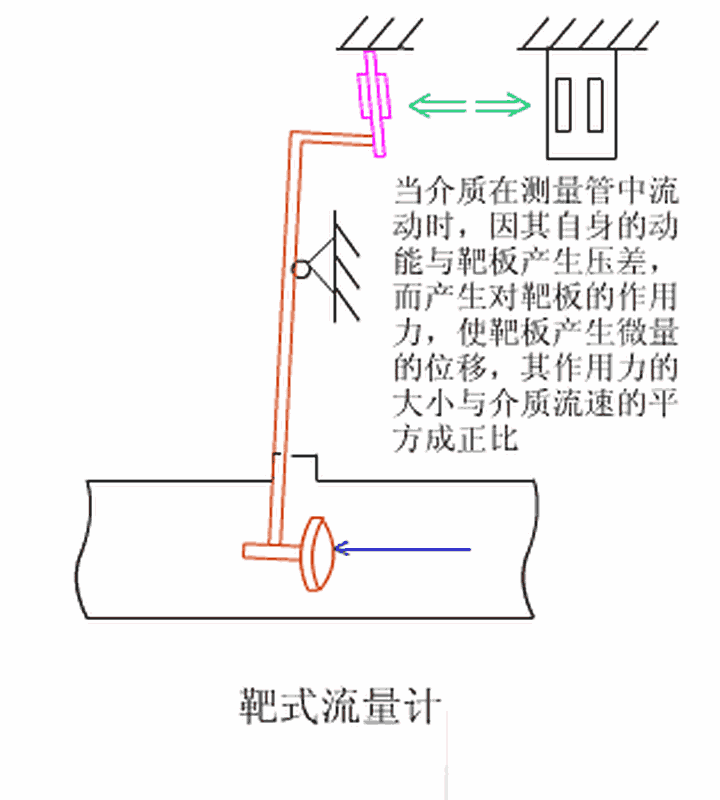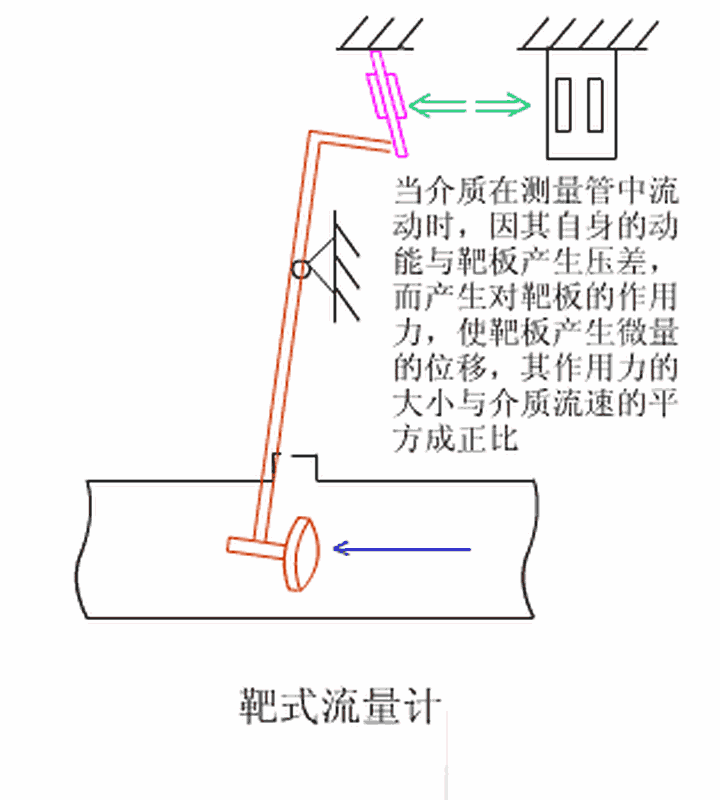



 蘇公網(wǎng)安備 32058302001350號
蘇公網(wǎng)安備 32058302001350號